บทที่ 2 อะตอมและสมบัติของธาตุ
2.1 แบบจำลองอะตอม
แบบจำลองอะตอมของดอลตัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1.ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2.อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3.สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
- อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน
แบบจะลองอะตอมของทอมสัน
ในปลายคริสต์ศตวรรษที่ 19 ได้มีการค้นพบรังสีชนิดหนึ่ง ซึ่งเรียกว่า รังสีแคโทด (cathode ray) ที่ได้จากการทดลองของนักวิทยาศาสตร์ชื่อ Julius Plicker ซึ่งใช้หลอดแก้วที่สูบอากาศออก และมีอิเล็กโตรด 2 อันอยู่คนละข้าง (แอโนดเป็นขั้วไฟฟ้าบวกและแคโทดเป็นขั้วไฟฟ้าลบ)ของหลอดแก้ว และต่อไปยังไฟฟ้าที่มีศักย์สูง ทำให้เกิดรังสีขึ้นภายในหลอดแก้ว เรียกว่า รังสีแคโทด
สมบัติของรังสีแคโทด
1.รังสีแคโทดสามารถทำให้ฉากเรืองแสงเกิดเรืองแสงได้
2.เมื่อให้รังสีแคโทดอยู่ระหว่างขั้วไฟฟ้ารังสีแคโทดจะเบนเข้าหาขั้วบวกแสดงว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุไฟฟ้า เป็นลบซึ่งต่อมาเรียกว่า อิเล็กตรอน
3.เมื่อให้รังสีแคโทดอยู่ในสนามแม่เหล็กจะเกิดการเบี่ยงเบนออกจากแนวเส้นตรง
4.รังสีแคโทดเดินทางเป็นเส้นตรงจากแคโทดไปยังแอโนดถ้ามีวัตถุทึบแสงมากั้นทางเดินของรังสีก็จะทำให้เกิดเงา
การค้นพบรังสีแคโทด เมื่อปี ค.ศ.1833 ไมเคิล ฟาราเดย์ (Michael Faraday) ได้ทำการศึกษาเกี่ยวกับแยกสลายไฟฟ้า (electrolysis) โดยผ่านเข้ากระแสไฟฟ้าเข้าไปในสารละลายชี้ให้เห็นว่าสารละลายต่างๆ ประกอบด้วยอะตอม เมื่อได้รับกระแสไฟฟ้าอะตอมบางส่วนหลุดออกมาซึ่งเป็นอนุภาคไฟฟ้า ดังนั้นโครงสร้างภายในของอะตอมจะต้องเกี่ยวข้องกับอนุภาคไฟฟ้า ซึ่งต่อมา ทอมสัน (J.J. Thomson) ได้ใช้หลอดรังสีแคโทด (cathode ray tube) ซึ่งเป็นหลอดแก้วภายในบรรจุแก๊สความดันต่ำ ขั้วอิเล็กโทรดที่ท้าด้วยโลหะเมื่อผ่านกระแสไฟฟ้าที่มีศักย์สูงๆ จะสังเกตว่ามีการไหลของกระแสไฟฟ้าเกิดขึ้นโดยมีทิศทางการไหลจากขั้วแคโทด (ขั้วลบ) และทะลุผ่านขั้วของแอโนด (ขั้วบวก) ไปกระทบกันฉากที่เคลือบด้วยสารเรืองแสงท้าให้เห็นเป็นแสงสว่างเกิดขึ้น เรียกรังสีที่เกิดขึ้นนี้ว่า รังสีแคโทด (cathode ray)

นอกจากนี้ทอมสัน ยังพบว่ารังสีแคโทดสามารถเบี่ยงเบนในสนามไฟฟ้าและในสนามแม่เหล็ก โดยลำรังสีนี้จะเบนเข้าหาขั้วไฟฟ้าบวก ทอมสันจึงสรุปว่าล้ารังสีแคโทด เป็นอนุภาคประจุลบ เรียกอนุภาคนี้ว่า อิเล็กตรอน และสามารถคำนวณหาอัตราของประจุต่อมวล (e/m) ของอิเล็กตรอนได้เท่ากับ 1.76×10ยกกำลัง8 คูลอมบ์ต่อกรัม
การค้นพบรังสีบวก
ในปี พ.ศ. 2409 (ค.ศ. 1866) ออยเกน โกลด์ชไตน์ได้ทำการทดลองโดยเจาะรูที่ขั้วแคโทดในหลอดรังสีแคโทดพบว่าเมื่อผ่านกระแสไฟฟ้าเข้าไปในหลอดรังสีแคโทดจะมีอนุภาคชนิดหนึ่งเคลื่อนที่เป็นเส้นตรงไปในทิศทางตรงกันข้ามกับการเคลื่อนที่ของรังสีแคโทดผ่านรูของขั้วแคโทดและทำให้ฉากด้านหลังขั้วแคโทดเรืองแสงได้ โกลด์ชไตน์ได้ตั้งชื่อว่า “รังสีแคแนล” (canal ray) หรือ “รังสีบวก” (positive ray)
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
ลักษณะแบบจำลองอะตอมของดอลตันทอมสัน
รอเบิร์ต แอนดรูวส์ มิลลิแกน
มิลลิแกน ได้ทำการทดลองเพื่อหาค่าประจุของอิเล็กตรอนโดยวิธีหยดน้ำมัน ทำได้โดย พ่นน้ำมันเป็นละอองเม็ดเล็ก ๆ ให้ตกลงมาระหว่างแผ่นโลหะ 2 แผ่น แล้วใช้รังสีเอกซ์ไปดึงอิเล็กตรอนออกจากอะตอมของก๊าซในอากาศ แล้วให้อิเล็กตรอนไปเกาะหยดน้ำมัน พบว่า แต่ละหยดน้ำมันมีอิเล็กตรอนมาเกาะจำนวนไม่เท่ากัน นั่นคือ หยดน้ำมันบางหยดมีอิเล็กตรอนเกาะติดเพียงตัวเดียว บางหยดก็มีมากกว่า 1 ตัว หยดน้ำมันจะตกลงมาตามแรงโน้มถ่วงของโลก จากนั้นให้กระแสไฟฟ้าเข้าไปในแผ่นประจุบวกและลบ แผ่นประจุลบซึ่งอยู่ด้านล่างผลักหยดน้ำมันที่มีอิเล็กตรอนมาเกาะจนหยุดนิ่ง ซึ่งดูได้ด้วกล้องจุลทรรศน์(microscope) แสดงว่า แรงโน้มถ่วงของโลกเท่ากับแรงจากสนามไฟฟ้า แล้วคำนวณหาค่าประจุจากผลการทดลองมิลลิแกนคำนวณหาค่าประจุของอิเล็กตรอนได้คือ 1.60 X 10-19 คูลอมบ์ ซึ่งเป็นค่าประจุของอิเล็กตรอน 1 อิเล็กตรอน
จากการทดลองของมิลลิแกน เราทราบค่า e = 1.60 X 10-19 คูลอมบ ์
์จากการทดลองของทอมสัน เราทราบค่า e/m = 1.76 X 108 คูลอมบ์/กรัม
m = 9.11 X 10-28 กรัม
ดังนั้น เราจะทราบมวลของอิเล็กตรอนเท่ากับ 9.11 X 10-28 กรัม
แบบจะลองอะตอมของรัทเทอร์ฟอร์ด
เออร์เนสต์ รัทเธอร์ฟอร์ด (Ernest Rutherford) ได้ทำการทดลองยิงอนุภาคแอลฟา(นิวเคลียสของอะตอมฮีเลียม ) ไปที่แผ่นโลหะบาง ในปี พ.ศ.2449 และพบว่าอนุภาคนี้ สามารถวิ่งผ่านได้เป็นจำนวนมาก แต่จะมีเพียงส่วนน้อยที่เป็นอนุภาคที่กระเจิง(การที่อนุภาคเบนจากแนวการเคลื่อนที่จากที่เดิมไปยังทิศทางต่างๆกัน ) ไปจากแนวเดิมหรือสะท้อนกลับทางเดิม
จากการทดลองนี้ รัทเธอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมว่า " อะตอมมีลักษณะโปร่ง ประกอบด้วยประจุไฟฟ้าบวกที่รวมกันอยู่ที่ศูนย์กลางเรียกว่า นิวเคลียส ซึ่งถือว่าเป็นที่รวมของมวลเกือบทั้งหมดของอะตอม โดยมีอิเล็กตรอนเคลื่อนที่รอบๆนิวเคลียสด้วยระยะห่างจากนิวเคลียสมาก เมื่อเทียบกับขนาดของนิวเคลียสและระหว่างนิวเคลียสกับอิเล็กตรอนเป็นที่ว่างเปล่า"แต่แบบจำลองนี้ยังมีข้อกังขาที่ยังไม่สามารถหาคำตอบได้คือ
1.อิเล็กตรอนที่เคลื่อนที่โดยมีความเร่งจะแผ่คลื่นแม่เหล็กไฟฟ้าออกมา ทำให้พลังงานจลน์ลดลง ทำไมอิเล็กตรอนวิ่งวนรอบนิวเคลียสตามแบบจำลองของรัทเธอร์ฟอร์ด จึงไม่สูญเสียพลังงาน และไปรวมอยู่ที่นิวเคลียส2. อะตอมที่มีอิเล็กตรอนมากกว่าหนึ่งตัว เมื่อวิ่งวนรอบนิวเคลียสจะจัดการเรียงตัวอย่างไร3. ประจุบวกที่รวมกันอยู่ในนิวเคลียส จะอยู่กันได้อย่างไร ทั้งๆที่เกิดแรงผลัก
แบบจะลองอะตอมของนีลโบร์
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,… ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ….
ลักษณะแบบจำลองอะตอมของนีลโบร์
แสง คือ คลื่นแม่เหล็กไฟฟ้า (Electromagnetic waves เรียกย่อๆ ว่า EM) ซึ่งประกอบด้วย สนามแม่เหล็กและสนามไฟฟ้าเคลื่อนที่ทำมุมตั้งฉากกันระยะทางระหว่างยอดคลื่นหนึ่งถึงยอดคลื่นถัดไปเรียกว่า ความยาวคลื่น (Wavelength)
แสงที่ตามองเห็น (Visible light) เป็นส่วนหนึ่งของคลื่นแม่เหล็กไฟฟ้า ในช่วงคลื่น 400 – 700 นาโนเมตร (1 nm = 10-9 m หรือ 1/พันล้านเมตร) หากนำแท่งแก้วปริซึมมาหักเหแสงอาทิตย์ เราจะเห็นว่าแสงสีขาวถูกหักเหออกเป็นสีม่วง คราม น้ำเงิน เขียว เหลือง แสด แดง คล้ายกับสีของรุ้งกินน้ำ เรียกว่า “สเปกตรัม” (Spectrum) แสงแต่ละสีมีความยาวคลื่นแตกต่างกัน สีม่วงมีความยาวคลื่นสั้นที่สุด (400 nm) สีแดงมีความยาวคลื่นมากที่สุด นอกจากแสงที่ตามองเห็นแล้วยังมีคลื่นแม่เหล็กไฟฟ้าชนิดอื่นๆเรียงตามขนาดความยาวคลื่นจากน้อยไปมาก |

นอกจากนักวิทยาศาสตร์จะแบ่งประเภทของคลื่นแม่เหล็กไฟฟ้าโดยใช้ความยาวคลื่นเป็นตัวกำหนดแล้ว แต่บางครั้งในวงการวิทยุโทรคมนาคม เรานิยมใช้ความถี่ของคลื่นเป็นตัวกำหนด เนื่องจากคลื่นแม่เหล็กไฟฟ้าทุกประเภทเดินทางโดยไม่ต้องใช้ตัวกลางด้วยความเร็วคงที่ 300,000,000 เมตร/วินาที เราสามารถคำนวณหาค่าความถี่ได้โดยใช้สูตร
λ = c / f
ความยาวคลื่น = ความเร็วแสง / ความถี่
ความยาวคลื่น (λ) = ระยะห่างระหว่างยอดคลื่น มีหน่วยเป็นเมตร (m)
ความถี่ (f) = จำนวนคลื่นที่เคลื่อนที่ผ่านจุดที่กำหนด ในระยะเวลา 1 วินาที มีหน่วยเป็นเฮิรทซ์ (Hz)
ความเร็วแสง (c) = 300,000,000 เมตร/วินาที (m/s)
แบบจำลองอะตอมของกลุ่มหมอก
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
ลักษณะแบบจำลองอะตอมของกลุ่มหมอก
2.3อนุภาคในอะติมและไอโซโทป
อนุภาคในอะตอม
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่โปรตอน นิวตรอน และอิเล็กตรอนอนุภาคขนาดเล็กคือโปรตอน, นิวตรอน และอิเล็กตรอน มีคุณสมบัติต่างกันดังตาราง
จากตารางอะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ “เลขอะตอม” จำนวนโปรตอน = จำนวนอิเล็กตรอน โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ “เลขมวล” เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
โปรตอน อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียส (Neucleus)มีอนุภาคเป็นบวกจำนวนโปรตอนใน อะตอมของธาตุเรียกว่า อะตอมมิค นัมเบอร์ ถ้าธาตุใดมีอะตอมมิค นัมเบอร์ เท่ากันเรียกธาตุเหล่านี้ว่าเป็นไอโซโทป ซึ่งกันและกันกล่าวคือ เป็นธาตุที่มีจำนวนโปรตอนเท่ากัน แต่มีจำนวนนิวตรอนต่างกัน
นิวตรอน
อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียสรวมกับโปรตอนมีน้ำหนักมากกว่าโปรตอนเล็กน้อยและมีคุณสมบัติเป็นกลางทางไฟฟ้า ผลรวมระหว่างโปรตอนและนิวตรอนใน 1 อะตอมของธาตุ เราเรียกว่า อะตอมมิค แมส หรือแมส นัมเบอร์ ถ้าธาตุใดมีแมส นัมเบอร์ เท่ากันแต่อะตอมมิค นัมเบอร์ ไม่เท่ากันเรา เรียกธาตุเหล่านี้ว่าเป็นไอโซบาร์ซึ่งกันและกัน
อิเล็กตรอน
อนุภาคชนิดนี้มีคุณสมบัติทางไฟฟ้าเป็นประจุลบ วิ่งอยู่รอบ ๆ นิวเคลียสของอะตอมของธาตุด้วยความเร็วสูงในวงโคจร ที่เฉพาะของมัน เป็นอนุภาคที่มีน้ำหนักน้อย หนักประมาณ เท่าของน้ำหนักของโปรตอนอิเล็กตรอนจะได้รับแรงดึงดูดจากโปรตอนในนิวเคลียสถ้าอิเล็กตรอนเหล่านั้นได้รับพลังงานเพิ่มมันอาจจะ กระโดดออกไปยังเซลล์ต่อไปได้ อิเล็กตรอนในเซลล์รอบนอกสุดมีบทบาทสำคัญมากทั้งในด้านคุณสมบัติทางฟิสิกส์และเคมี โดยเฉพาะในด้านไฟฟ้า อิเล็กตรอนในเซลล์นี้เรียกว่า เวเลนซ์อิเล็กตรอน ถ้าอิเล็กตรอนในเซลล์นี้ได้รับพลังงานเพิ่มมันจะกระโดดหายไปจากอะตอมของธาตุ ทำให้อะตอมมีลักษณะพร่องอิเล็กตรอนจึงมี ีสภาพทางไฟฟ้าเป็นบวก ในทางตรงกันข้ามถ้ามันสูญเสียพลังงาน มันจะ ได้รับอิเล็กตรอนเพิ่มทำให้มีสภาพ ้ทางไฟฟ้าเป็นลบ ดังนั้นอิเล็กตรอนเท่านั้นที่เคลื่อนที่ได้ จึงทำให้เกิดการไหลของกระแสไฟฟ้าโดยปกติสารที่เป็นกลางทางไฟฟ้าจะมีโปรตอนและอิเล็กตรอนเท่ากัน สารใดสูญเสียอิเล็กตรอนจะมี คุณสมบัติทางไฟฟ้าเป็นบวก สารใดที่รับอิเล็กตรอนเพิ่มจะมีคุณสมบัติทางไฟฟ้าเป็นลบ
สรุป
อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
จำนวนโปรตอน = จำนวนอิเล็กตรอน
โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
เราสามารถเขียนเป็นสัญลักษณ์เพื่อระบุเลขอะตอมและเลขมวลได้ดังนี้

A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เช่น 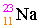
เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
11 = จำนวนโปรตอน = จำนวนอิเล็กตรอน เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
23 = 11 + จำนวนนิวตรอน
จำนวนนิวตรอน = 23 - 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
2.3การจัดเรียงอิเล็กตรอนในอะตอม
จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
ระดับพลังงานหลักและระดับพลังงานย่อย
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย
ออร์บิทัล
จากการศึกษาพบว่ากรณีของอะตอมที่มีหลายอิเล็กตรอนนั้นระดับพลังงานของ 3d จะใกล้กับ 4s มาก และพบว่า ถ้าบรรจุอิเล็กตรอนใน 4s ก่อน 3d พลังงานรวมของอะตอมจะต่ำ และอะตอมจะเสถียรกว่า ดังนั้นในการจัดเรียงอิเล็กตรอนในออร์บิทัลแบบที่เสถียรที่สุด คือการจัดตามระดับพลังงานที่ต่ำที่สุดก่อนทั้งในระดับพลังงานหลักและย่อย ซึ่งวิธีการจัดอิเล็กตรอนสามารถพิจารณาตามลูกศรในรูปที่ 1.8 โดยเรียงลำดับได้เป็น 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p

หลักการจัดเรียงอิเล็กตรอนในอะตอม
ในการจัดอิเล็กตรอนอาจเขียนเป็นแผนภาพออร์บิทัลซึ่งแสดงสปินของอิเล็กตรอนด้วย ดังตัวอย่าง C มี z = 6 มีโครงแบบอิเล็กตรอนเป็น 1s2 2s2 2p2 ซึ่งการจัดแสดงสปินของอิเล็กตรอนแสดงในตารางที่ 1.1
ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัลจะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิทัลที่เหมาะสมตามหลักดังต่อไปนี้
1) หลักของเพาลี (Pauli exclusion principle) กล่าวว่า “ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ เหมือนกันได้ แต่ต่างกันที่สปิน
2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
2.1) สัญลักษณ์วงกลม O, หรือ _ แทน ออร์บิทัล
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง
ลูกศร↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
ลูกศร↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)
2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน ดังรูปที่ 1.1
3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น

4) การบรรจุเต็ม (filled configuration) เป็นการบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน แบบเต็ม ครบ 2 ตัว ส่วนการบรรจุครึ่ง (half- filled configuration) เป็นการบรรจุอิเล็กตรอนลงในออร์บิทัลแบบครึ่งหรือเพียง 1 ตัว เท่านั้น ซึ่งการบรรจุทั้งสองแบบ (ของเวเลนซ์อิเล็กตรอน) จะทำให้มีความเสถียรมากกว่าตัวอย่างการบรรจุเต็ม เช่น
2.4ตารางธาตุและสมบัติของธาตุหมู่หลัก
ตารางธาตุ หมายถึง ตารางที่นักวิทยาศาสตร์สร้างขึ้นมา เพื่อแบ่งธาตุที่มีสมบัติเหมือนกันออกเป็นหมวดหมู่ เพื่อให้ง่ายแก่การศึกษา โดยแบ่งธาตุทั้งหมดออกเป็นหมู่และคาบ
วิวัฒนาการของการสร้างตารางธาตุ
ปี พ.ศ. 2360 (ค.ศ. 1817) โยฮันน์ โวล์ฟกัง เดอเบอไรเนอร์ พยายามจัดธาตุเป็นกลุ่มๆละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่า ชุดสาม
พ.ศ. 2407 (ค.ศ. 1864) จอห์น นิวแลนด์ เสนอกฎการจัดธาตุเป็นหมวดหมู่ เรียงธาตุตามมวลอะตอมจากน้อยไปมาก พบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ ตารางธาตุมีวิวัฒนาการมาเรื่อยๆจนถึงปัจจุบันนี้

กลุ่มของธาตุในตารางธาตุ
แบ่งได้เป็น 3 กลุ่ม คือ ธาตุโลหะ ธาตุกึ่งโลหะ และธาตุอโลหะ โดยธาตุโลหะจะอยู่ทางซ้ายมือของตารางธาตุ ธาตุกึ่งโลหะจะอยู่บริเวณที่เป็นขั้นบันได และธาตุอโลหะจะอยู่ทางขวามือของตารางธาตุ ยกเว้นไฮโดรเจนที่อยู่ทางซ้ายมือของตาราง
ขนาดอะตอม
ขนาดไอออน
การบอกขนาดไอออนบอกเป็นค่ารัศมีไอออน

พลังงานไอออไนเซชัน
พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดจากอะตอมในสถานะแก๊สเรียกว่า พลังงานไอออไนเซชัน (IE) โดยค่า IE แสดงถึงความยากง่ายในการทำให้อะตอมในสถานะแก๊สกลายเป็นไอออนบวก โดย IE มากแสดงว่าทำให้เป็นไอออนบวกได้ยาก
ถ้าเป็นธาตุที่มีหลายอิเล็กตรอนก็จะมีพลังงานไอออไนเซชันหลายค่า พลังงานน้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกมาจากอะตอมที่อยู่ในสถานะแก๊สเรียกว่า พลังงานไอออไนเซชันลำดับที่หนึ่ง
สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอน เรียกว่า สัมพรรคภาพอิเล็กตรอน (EA) ถ้าค่า EA เป็นบวก หมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอน แสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะรับอิเล็กตรอนได้ดี
อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี (EN) คือความสามารถในการดึงดูดอิเล็กตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสาร เมื่อพิจารณาค่า EN ของธาตุในหมู่เดียวกันจะพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอม
2.5ธาตุแทรนซิชัน
ธาตุแทรนซิชัน คือ กลุ่มธาตุที่อยู่ระหว่างหมู่ IIA กับ IIIA ซึ่งก็คือธาตุหมู่ B ทั้งหมด ประกอบด้วยหมู่ IB – VIIIB รวมทั้ง อินเนอร์แทรนซิชัน ได้แก่ กลุ่มแลนทาไนด์ และกลุ่มแอกทิไนด์
ธาตุแทรนซิชัน เป็นธาตุที่ใช้อิเล็กตรอนในระดับพลังงานย่อย ในการเกิดพันธะ ยกเว้นธาตุหมู่ 2B ที่ใช้อิเล็กตรอนในระดับพลังงานย่อย s ในการเกิดพันธะ
สมบัติของธาตุ
1.โลหะทรานซิชันทุกธาตุจะเป็นโลหะ แต่มีความเป็นโลหะน้อยกว่าธาตุหมู่ IA และ IIA
2.มีสถานะเป็นของแข็งที่อุณหภูมิห้อง ยกเว้นปรอทที่เป็นของเหลว
3.มีจุดหลอมเหลว จุดเดือด และความหนาแน่นสูง
4.นำไฟฟ้าได้ดี ซึ่งในโลหะทรานซิชัน ธาตุที่นำไฟฟ้าได้ดีที่สุดคือ เงิน (คาบ 5) และรองลงมาคือ ทอง (คาบ 6)
5.นำความร้อนได้ดี
6.ธาตุทรานซิชันทั้งหมดมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นธาตุโครเมียม และทองแดง ที่มีเวเลนซ์อิเล็กตรอนเป็น 1
7.สารประกอบของธาตุเหล่านี้จะมีสีสัน
8.มีพลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมาก
9.ขนาดอะตอม จะมีขนาดไม่แตกต่างกันมากโดยที่
ในคาบเดียวกันจะเล็กจากซ้ายไปขวา
ในหมู่เดียวกันจะใหญ่จากบนลงล่าง
10.ธาตุเหล่านี้มีหลายออกซิเดชั่นสเตตส์ (oxidation states)
11.ธาตุเหล่านี้เป็นตัวเร่งปฏิกิริยา (catalysts)
ที่ดี
12.ธาตุเหล่านี้มีสีฟ้า-เงินที่อุณหภูมิห้อง (ยกเว้นทองคำและทองแดง)
13.สารประกอบของธาตุเหล่านี้สามารถจำแนกโดยการวิเคราะห์ผลึก
2.6 ธาตุกัมมันตรังสี
กัมมันตภาพรังสี
เป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงานสูงมากและไม่เสถียรจึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสีแอลฟา(α) บีตา(β) และแกมมา γ
สมบัติของรังสีบางชนิด
การสลายตัวของไอโซโทปกัมมันตรังสี
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดกับนิวเคลียสที่มีเลขอะตอมสูงกว่า 83 และมีจำนวนนิวตรอนต่อโปรตอนในจำนวนที่ไม่เหมาะสม
การแผ่รังสีบีตา เกิดกับนิวเคลียสที่มีจำนวนนิวตรอนมากกว่าโปรตอนมาก นิวตรอนในนิวเคลียสจะเปลี่ยนไปเป็นโปรตอนและอิเล็กตรอน โดยจะออกมาในรูปของรังสีบีตาและนิวเคลียสใหม่จะมีเลขอะตอมเพิ่มมาอีก 1 โดยที่เลขมวลยังเท่าเดิม
การแผ่รังสีแกมมา เกิดกับไอโซโทปกัมมันตรังสีที่มีพลังงานสูงมาก หรือไอโซโทปที่สลายตัวให้รังสีแอลฟาหรือบีตา แต่นิวเคลียสที่เกิดใหม่ยังไม่เสถียรเพราะมีพลังงานสูงจึงเกิดการเปลี่ยนแปลงในนิวเคลียสให้มีพลังงานต่ำลงโดยปล่อยออกมาในรูปรังสีแกมมา
อันตรายจากไอโซโทปกัมมันตรังสี
กิจวัตรต่างๆในชีวิตประจำวันของมนุษย์มีโอกาสได้รับรังสีจากไอโซโทปรังสีเข้าสู่ร่ากายอยู่แล้ว นอกจากนี้ยังได้รับรังสีคอสมิกอีกด้วย โดยรังสีต่างๆเหล่านี้มีแหล่งกำเนิดมาจากธรรมชาตินอกจากนั้นบางอย่างก็เป็นรังสีที่มนุษย์เป็นผู้สร้างขึ้นมา เช่น รังสีจากเครื่องเอกซ์เรย์
ปริมาณรังสีที่มนุษย์ได้รับโดยประมาณในแต่ละวัน
รังสีคอสมิก 12%
เครื่องมือแพทย์ 17%
อากาศ 40%
อาหารและเครื่องดื่ม 15%
หินและดิน 15%
อื่นๆ 1%
สำหรับหน่วยงานที่เกี่ยวข้องกับรังสีจะต้องแสดงสัญลักษณ์รังสีลงบนฉลากของภาชนะหรือเครื่องมือรวมทั้งบริเวณใกล้เคียง เพื่อให้ผู้พบเห็นระมัดระวัง
ครึ่งชีวิตของไอโซโทปกัมมันตรังสี
ครึ่งชีวิต ใช้สัญลักษณ์ t1/2 หมายถึง ระยะเวลาที่นิวเคลียสของไอโซโทปกัมมันตรังสีสลายตัวจนเหลือครึ่งนึของปริมาณเดิม

ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสี อาจเกิดจากการแตกตัวหรือการรวมตัวของนิวเคลียสอะตอมที่มีขนาดใหญ่และเล็กกว่าได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่
ปฏิกิริยาที่นิวเคลียสของไอโซโทปของธาตุหนักแตกออกเป็นไอโซโทปธาตุที่เบากว่า เรียกว่า ฟิชชัน และถ้าเกิดฟิชชันต่อไปเรื่อยๆก็จะเรียกว่าปฏิกิริยาลูกโซ่ และในกรณีที่ไอโซโทปธาตุเบารวมตัวกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่าเดิมมากเรียกว่า ฟิวชัน
เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
ด้านธรณีวิทยา ใช้ C-14 หาอายุวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านการแพทย์ ใช้ศึกษาความผิดปกติของอวัยวะต่างๆในร่างกาย เช่น ให้คนไข้ดื่มสารละลาย I-131 เพื่อดูความผิดปกติของต่อมไทรอยด์ ใช้ I-132 ดูสภาพสมอง ฉีด Na-24 เพื่อตรวจดูระบบไหลเวียนของเลือด
ด้านเกษตรกรรม ใช้ติดตามระยะเวลาการหมุนเวียนแร่ธาตุในพืชหรือจำนวนแร่ธาตุที่พืชสะสมไว้ที่ใบ
ด้านอุสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่าง เช่น ใช้ตรวจหารอยตำหนิหรือรอยรั่วของท่อขนส่งของเหลว ใช้ทำให้อัญมณีสวย ใช้ในการเก็บถนอมอาหาร ฯลฯ
2.7 การนำธาตุไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิต
ประโยชน์ของธาตุ
ธาตุโลหะ นำความร้อนและนำไฟฟ้าได้ดี นิยมนำมาทำเป็นอุปกรณ์ไฟฟ้า
ธาตุกึ่งโลหะ มีสมบัติก้ำกึ่งระหว่างโลหะและอโลหะ นำไฟฟ้าได้ไม่ดี นิยมนำมาทำเป็นสารกึ่งตัวนำ ซึ่งมีสมบัติในการนำไฟฟ้าอยู่ระหว่างตัวนำและฉนวนเพื่อใช้เป็นวัสดุทำอุปกรณ์อิเล็กทรอนิกส์ต่างๆ
ธาตุหมู่ 18 หรือ VIIA เป็นธาตุเฉื่อยต่อการเกิดปฏิกิริยาจึงนำมาใช้ประโยชน์ตามสมบัติของแก๊สมีสกุล
ธาตุที่มีไอโซโทปกัมมันตรังสี สามารถนำมาใช้ประโยชน์ได้หลากหลายดังที่กล่าวไปในหัวข้อ 2.6.6 แม้ธาตุอยู่ในกลุ่มเดียวกันจะมีสมบัติคล้ายกัน แต่ธาตุทุกชนิดยังมีสมบัติต่างกัน ดังนั้นการนำไปใช้ประโยชน์จึงมีความจำเพาะต่างกัน
ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
ธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น เมื่อตะกั่วเข้าสู่ร่างกายจะทำให้มีอาการอ่อนเพลีย ปวดท้อง ท้องอืด เบื่ออาหาร ปวดกล้ามเนื้อ ปวดกระดูกและข้อ ความดันโลหิตสูง โลหิตจาง ความจำเสื่อม ภูมิต้านทานลดลงและขัดขวางการทำงานของเอนไซม์ในร่างกาย
ธาตุบางชนิดแม้ไม่ได้มีสมบัติเป็นพิษร้ายแรงแต่การนำมาใช้ไม่ถูกวิธีก็ส่งผลให้เกิดความเสียหายต่อชีวิตและทรัพย์สินได้เช่นกัน
https://boonmawong.wordpress.com/
http://class408mst.blogspot.com/



























ไม่มีความคิดเห็น:
แสดงความคิดเห็น