บทที่ 3 พันธะเคมี
3.1 สัญลักษณ์แบจุดของลิวอิสแลพกฎออกเตด
สูตรโครงสร้างแบบจุด
สูตรโครงสร้างแบบจุด เป็นการเขียนเฉพาะอิเล็กตรอนในชั้นพลังงานนอกสุดหรือเวเลนซ์อิเล็กตรอนของแต่ละธาตุ โดยใช้จุดแทนอิเล็กตรอน 1 ตัว และใช้จุด 2 จุดแทนอิเล็กตรอนคู่ร่วมพันธะหรือเส้น (-) ก็ได้ เราอาจเรียกโครงสร้างแบบจุดนี้ว่า “โครงสร้างลิวอิส” (Lewis Structure)
หลักการเขียนโครงสร้างแบบจุด
1.ให้เขียนอะตอมทั้งหมด โดยให้อะตอมที่เกิดพันธะอยู่ใกล้กัน
2.หาจำนวนเวเลนซ์อิเล็กตรอนทั้งหมด
3.ใส่จุดแทนเวเลนซ์อิเล็กตรอนรอบอะตอมเป็นคู่ๆ โดยจัดให้แต่ละอะตอมมีจำนวนอิเล็กตรอนล้อมรอบครบ 8 ตัว (ยกเว้น He = 2 , Be = 4 , B = 6)
4.ในกรณีที่ใช้เวเลนซ์อิเล็กตรอนจนหมดแล้ว แต่อะตอมมีอิเล็กตรอนไม่ครบ 8 ตัว นั้นหมายถึงว่า อาจมีพันธะคู่หรือพันธะสามเกิดขึ้น
5.กรณีที่มีอะตอม 3 ตัว อะตอมที่อยู่ตรงกลาง คือ อะตอมที่มีค่าอิเล็กโทเนกาติวิตีต่ำ
กฎออกเตต (Octet rule)
จากการศึกษาเกี่ยวกับธาตุเฉื่อยเช่น He, Ne, Ar, Kr พบว่าเป็นธาตุที่จัดอยู่ในประเภทโมเลกุลอะตอมเดียวทุกสถานะ คือใน 1 โมเลกุลของธาตุเฉื่อยจะมีเพียง 1 อะตอมทั้งสถานะของแข็ง ของเหลว และก๊าซในธรรมชาติเกือบจะไม่พบสารประกอบของธาตุเฉื่อยเลย
แสดงว่าธาตุเฉื่อยเป็นธาตุที่เสถียรมาก
ดังนั้นธาตุต่างๆ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 8จึงพยายามปรับตัวให้มีโครงสร้างแบบธาตุเฉื่อยเช่น
โดยการรวมตัวกันเป็นโมเลกุลหรือใช้อิเล็กตรอนร่วมกันเพื่อทำให้เวเลนต์อิเล็กตรอนเท่ากับ 8
ส่วนไฮโดรเจนจะพยายามปรับตัวให้มีเวเลนต์อิเล็กตรอนเท่ากับ 2 เหมือนธาตุ He

ข้อยกเว้นสำหรับกฎออกเตต
ดังที่ได้กล่าวมาแล้วว่าอะตอมของธาตุต่าง ๆ มักจะรวมตัวกันเป็นสารประกอบเพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้สารประกอบนั้นอยู่ในสภาพที่เสถียรเช่น H2O, PCl3, NH3, CO2 แต่อย่างไรก็ตามเมื่อมีการศึกษาให้กว้างขวางออกไป ก็พบว่าสารประกอบบางชนิดมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามกฎออกเตต บางชนิดมีเวเลนต์อิเล็กตรอนน้อยกว่า 8 และบางชนิดมีเวเลนต์อิเล็กตรอนมากกว่า 8 ซึ่งสารต่างๆ เหล่านี้แม้ว่าจะไม่เป็นไปตามกฎออกเตต แต่ก็อยู่ในภาวะที่ไม่เสถึยร จัดว่าเป็นข้อยกเว้นสำหรับกฎออกเตต ซึ่งสรุปได้ดังนี้
1.พวกที่ไม่ครบออกเตต
ได้แก่สารประกอบของธาตุในคาบที่ 2 ของตารางธาตุ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 4 เช่น4Be และ 5B
4Be = 2 , 2 เวเลนต์อิเล็กตรอนเท่ากับ 2
5B = 2 , 3 เวเลนต์อิเล็กตรอนเท่ากับ 3
ธาตุ Be และ B เมื่อเกิดเป็นสารประกอบโคเวเลนต์ทั่ว ๆ ไปจะไม่ครบออกเตต
2.พวกที่เกินกฎออกเตต
ตามทฤษฎีสารประกอบของธาตุที่อยู่ในคาบที่ 3ของตารางธาตุเป็นต้นไป สารมารถสร้างพันธะแล้วทำให้อิเล็กตรอนเกิน 8 ได้ (ตามกฎการจัดอิเล็กตรอน 2n2 ในคาบที่ 3 สามารถมีอิเล็กตรอนได้เต็มที่ถึง 18 อิเล็กตรอน) นอกจากสารประกอบที่ไม่เป็นไปตามกฎออกเตตดังที่ได้กล่าวมาแล้ว ยังมีสารประกอบอื่น ๆ อีกบางชนิดซึ่งไม่เป็นไปตามกฎออกเตต เช่น ออกไซด์บางตัวของธาตุไนโตรเจน ( NO และ NO2 )และออกไซด์ของคลอรีน (ClO2) เป็นต้น ธาตุเหล่านี้ (N และ Cl) สามารถมีอิเล็กตรอนที่ไม่ได้จับคู่ หรืออิเล็กตรอนเดี่ยว (Unpaired electron) ซึ่งทำให้แสดงสมบัติเป็น paramagnetic ได้
สารประกอบอื่นๆ สามารถตรวจสอบว่าเป็นไปตามกฎออกเตตหรือไม่ ทำได้โดยนับอิเล็กตรอนจากอะตอมกลางดังนี้
- นับเวเลนซ์อิเล็กตรอนของอะตอมกลางของธาตุนั้นๆ
- นับจำนวนแขนที่เกิดกับอะตอมกลาง
- นับประจุลบของไอออนนั้นๆ
3.2 พันธะไออนิก
การเกิดพันธะไอออนิก
มีประจุไฟฟ้าต่างกันยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าของธาตุโลหะที่มีพลังงานไอออไนเซชันกับธาตุอโลหะที่มีสัมพรรคภาพอิเล็กตรอนสูง เรียกการยึดเหนี่ยวนี้ว่า พันธะไอออนิก
สารประกอบไอออนิกในสถานะของแข็งยู่ในรูปของผลึกที่มีไอออนบวกและลบยึดเหนี่ยวกันด้วยพันธะไอออนิกอย่างต่อเนื่องกันไปทั้งสามมิติเป็นโครงผลึก
สูตรเคมีและชื่อของสารประกอบไอออนิก

พลังงานกับการเกิดสารประกอบไอออนิก
ปฏิกิริยาเคมีนอกจากจะเกี่ยวกับการเปลี่ยนแปลงของสารเคมีแล้วส่วนใหญ่ยังเกี่ยวกับการเปลี่ยนแปลงพลังงานด้วย ซึ่งพลังงานเกิดของสารสามารถประกอบสามารถหาได้จากการทดลองในการทำปฏิกิริยาระหว่างธาตุ
พลังงานที่เกี่ยวข้องกับการรวมกันของไอออนบวกและลบในสารประกอบไอออนิกเรียกว่า พลังงานโครงผลึก สามารถหาค่าพลังงานได้ด้วยการคำนวณ โดยอาศัยวัฏจักรบอร์น-ฮาเบอร์ ประกอบด้วยขั้นตอนต่างๆดังนี้
- ของแข็งระเหิดกลายเป็นแก๊ส เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานการระเหิด
- พลังงานที่ใช้ในการเสียอิเล็กตรอนให้กลายเป็นไอออนบวกเป็นไอออนลบ เรียกว่า พลังงานไอออไนเซชัน
- พลังงานที่ใช้ในการสลายโมเลกุลของแก๊สให้เป็นอะตอมในสถานะแก๊ส เรียก พลังงานการสลายพันธะ
- พลังงานที่คายออกมาเมื่อมีการรับอิเล็กตรอนให้กลายเป็นประจุลบเรียกว่า พลังงานสัมพรรรคภาพอิเล็กตรอน
- พลังงานที่ได้ออกมาเมื่อมีการยึดไอออนบวกกับไอออนลบให้กลายเป็นของแข็ง เรียกว่า พลังงานโครงผลึกหรือพลังงานแลตทิซ
สมบัติของสารประกอบไอออนิก
1. มีขั้ว เพราะสารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมาก ซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเล็กตรอนทำให้อิเล็กตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
สมการไอออนิกและสมการไอออนิกสุทธิ์
1. สมการโมเลกุล (molecular equation) เป็นการเขียน แสดงสารทุกชนิดในรูปโมเลกุล (หน่วยสูตร)
ไม่ต้องแยกออกเป็นไอออน แต่เป็นที่เข้าใจว่าส่วนใดเป็นไอออนบวก ส่วนใดเป็นไอออนลบ และส่วนใดคือ
ส่วนที่ตกตะกอน เช่น
Pb(NO3)(aq) + 2KI(aq) → PbI2(s) + 2KNO3(aq)
สารที่มี (aq) อยู่ข้าง ๆ หมายถึงเป็นสารที่แตกตัวเป็นไอออน ซึ่งก็คือสารที่ละลายน้ำได้
สารที่มี (s) อยู่ข้าง ๆ หมายถึงสารที่ตกตะกอน
2. สมการไอออนิกแบบรวม (over all Ionic equation) เป็นการเขียนแสดงสารแต่ละชนิดเมื่อแตกตัวเป็น
ไอออน โดยเขียนครบทุกไอออน เช่น
Pb2+(aq) + 2NO3-(aq) + K+(aq) + 2I- (aq) → PbI2(s) + 2NO3-(aq) + 2K+(aq)
ให้สังเกตที่ (aq) และ (s) แสดงการละลายได้และการตกตะกอน ตามลำดับ
3. สมการไอออนิกสุทธิ (net-ionic equation) กรณีนี้เขียนเฉพาะไอออนที่รวมตัวกันแล้วตกตะกอนเท่านั้น
ได้แก่
Pb2+(aq) + 2I- (aq) → PbI2(s)
ปฏิกิริยาการเกิดตะกอนของสารประกอบไอออนิกในน้ำอาจเขียนแทนได้ด้วย สมการไอออนิก ที่แสดงไอออนในสารละลายทุกชนิด
ไอออนในสมการของ)ฏิกิริยาที่มีน้ำเป็นตัวทำละลาย แสดงสถานะของไอออนเป็น aq (aqueous solution) และในบรรทัดสุดท้ายของสมการซึ่งตัดไอออนที่ไม่ทำปฏิกิริยากันออกแล้ว เราเรียกว่า สมการไอออนิกสุทธิ
การอธิบายหรือทำนายปฏิกิริยาการเกิดตะกอนของสารละลายของสารประกอบไอออนิกพิจารณาได้จากสมบัติการละลายน้ำ ตามหลักการเบื้องต้นดังนี้
สารประกอบละลายน้ำ
1.สารประกอบโลหะแอลคาไลและแอมโมเนียมทุกชนิด
2.สารประกอบไนเตรต คลอเรต เปอร์คลอเรต
แอซีเตตทุกชนิด
3.สารประกอบคลอไรด์ โบรไมด์ ไอโอไดด์
4.สารประกอบซัลเฟต (ยกเว้นของ Pb Sr Ba ไม่ละลายน้ำ
ส่วน Ca และ Ag ละลายน้อย)
5.สารประกอบไม่ละลายน้ำ
6.สารประกอบออกไซด์ของโลหะ
7.สารประกอบไฮดรอกไซด์
8.สารประกอบคาร์บอเนต ฟอสเฟต ซัลไฟด์
และซัลไฟต์ (ยกเ้นสารประกอบของแอมโมเนียมและของโลหะแอลคาไล)
3.3พันธะโคเวเลนต์
การเกิดพันธะโคเวเลนต์
ธาตุอโลหะมีค่าอิเล็กโทรเนกาติวิตีสูง เมื่อรวมตัวกันจะไม่มีอะตอมใดยอมเสียอิเล็กตรอนจึงยึดเหนี่ยวกันโดยใช้เวเลนซ์อิเล็กตรอนร่วมกันเรียกการยึดเหนี่ยวนี้ว่า พันธะโคเวเลนต์ และเรียกสารที่อะตอมใช้ยึดเหนี่ยวกันว่า สารโคเวเลนต์
พันธะโคดเวเลนต์ที่เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 คู่ เรียกว่า พันธะเดี่ยว โดยอิเล็กตรอนคู่ที่ใช้ร่วมกันในการเกิดพันธะเรียกว่า อิเล็กตรอนคู่ร่วมพันธะ ส่วนคู่ที่ไม่เกิดพันธะเรียกว่า อิเล็กตรอนคู่โดดเดี่ยว
อะตอมที่ใช้เวเลนซ์อิเล็กตรอนร่วมกัน 2 คู่ เรียกว่า พันธะคู่ และถ้าใช้เวเลนซ์อิเล็กตรอนร่วมกัน 3 คู่ก็จะเรียกว่า พันธะสาม
สูตรโมเลกุลและชื่อของสารโคเวเลนต์
การเรียกชื่อสารโคดวดลนต์ มีหลักการดังนี้
- ถ้าประกอบด้วยธาตุชนิดเดียว เรียกชื่อตามธาตุนั้นโดยระบุสถานะด้วย ซึ่งส่วนใหญ่มีสถานะเป็นแก๊สที่อุณหภูมิห้อง
- ถ้าประกอบด้วยธาตุ 2 ชนิด เรียกตามลำดับที่ปรากฏในสูตรโมเลกุลโดยเปลี่ยนพยางค์หลังเป็นเสียง ไ-ด์ (-ide) และระบุจำนวนอะตอมธาตุองค์ประกอบในโมเลกุลด้วยคำในภาษากรีกตามตารา
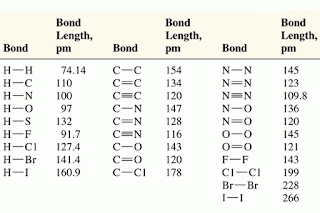
ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
ตารางแสดงความยาวพันธะบางพันธะ
กราฟแสดงการเปลี่ยนแปลงพลังงานในการเกิดโมเลกุล

สภาพขั้วของโมเลกุลโคเวเลนต์
ถ้ามีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอตอมทั้งสองเท่ากัน เรียกว่า พันธะโคเวเลนต์ไม่มีขั้ว ส่วนสารโคดวดลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีต่างกันจะมีการกระจายตัวของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมไม่เท่ากัน เรียกว่า พันธะโคเวเลนต์มีขั้ว
δ+ แทนประจุไฟฟ้าค่อนข้างบวกในอะตอม δ- แทนประจุไฟฟ้าค่อนข้างลบในอะตอม
ขั้วของพันธะทำให้โมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุชนิดเดียวกันเป็น
โมเลกุลไม่มีขั้ว ส่วนถ้าประกอบด้วยธาตุต่างชนิดกันเป็น
โมเลกุลมีขั้ว

แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
ที่อุณหภูมิห้อง สารโคเวเลนต์แต่ละชนิดอาจอยู่ในสถานะที่ แตกต่างกัน ขึ้นอยู่กับแรงยึดเหนี่ยวระหว่างโมเลกุลหรือแรงแวนเดอร์วาลส์
แรงยึดเหนี่ยวระหว่างโมเลกุลเกี่ยวข้องกับขนาดโมเลกุลและสภาพขั้วของโมเลกุล ซึ่งจะกล่าวถึง 3 ชนิด ได้แก่
- แรงแผ่กระจายลอนดอน เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลไม่มีขั้วหรืออะตอมแก๊สโมเลกุลเป็นแรงอ่อนๆ โดยแรงจะเพิ่มขึ้นตามขนาดของโมเลกุล
- แรงระหว่างขั้ว เกิดจากสภาพขั้วโมเลกุลโดยโมเลกุลที่อยู่ใกล้กันจะหันส่วนของโมเลกุลที่มีขั้วตรงข้ามกันเข้าหากันเกิดเป็นแรงดึงดูดทางไฟฟ้าจากสภาพขั้ว โดยทั่วไปแรงนี้จะเพิ่มขึ้นตามสภาพขั้วของโมเลกุลที่มีขนาดใกล้เคียงกัน
- พันธะไฮโดรเจน
สารโคเวเลนต์โครงร่างตาข่าย
สารที่มีพันธะโคเวเลนต์เชื่อมต่อกันเป็นโครงร่างตาข่ายเรียกว่า สารโคเวเลนต์โครงร่างข่าย ทำให้สารบางชนิดเป็นอัญรูป
3.4พันธะโลหะ
พันธะโลหะ (Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลวอะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอกของมันเทียบกับคาบ(period)หรือระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้ เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของไอออนบวกพันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากในโลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง อาจจะมีเป็นล้านๆ อะตอมก็ได้
แบบจำลองทะเลอิเล็กตรอน (Sea of electrons)
การเกิดพันธะในโลหะนี้ ทำให้โลหะมีสมบัติต่างๆ ดังนี้
- นำไฟฟ้าและความร้อนได้ดี
- มีจุดเดือดและจุดหลอมเหลวสูง
- มีลักษณะเป็นเงาและมีความวาวเมื่อถูกแสง
- สามารถดึงเป็นเส้น ตีเป็นแผ่น หรือบิดงอได้
3.4การใช้ประโยชน์ของสารประกอบไอออนิก สารโคเวเลยต์ และ
โลหะ
สมบัติบางประการของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบไอออนิกสารโคเวเลนต์และโลหะมีสมบัติเฉพาะตัวมาว่าการที่ต่างกันจึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์และซิงค์คลอไรด์ เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้าได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอลูมิเนียมและเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กระทะ
ที่มา https://pubhtml5.com/
http://thn25669ch.blogspot.com/


















ไม่มีความคิดเห็น:
แสดงความคิดเห็น